درمان سرطان ریه : تمامی راه های درمانی که وجود دارد!
درمان سرطان ریه مبتنی بر جراحی، شیمی درمانی و رادیوتراپی است. در مراحل پیشرفته، رویکردهای درمانی جدید مانند درمانهای هدفمند نیز در دسترس هستند. اینکه کدام یک از رویکردهای درمانی فوق الذکر به صورت جداگانه یا ترکیبی مورد استفاده قرار میگیرد، بستگی به وضعیت بیمار دارد.
بیماران مبتلا به کارسینوم سلول کوچک معمولاً در زمان تشخیص در مرحله پیشرفته هستند. تومور اغلب قسمتهای بزرگی از بافت ریه را تحت تأثیر قرار داده است و قبلاً متاستازهایی در سایر قسمتهای بدن ایجاد کرده است. برداشتن کامل بافت سرطانی با جراحی دیگر در این موارد امکانپذیر نیست. با این حال، تومورهای سلول کوچک در مقایسه با کارسینومهای سلول غیر کوچک به شیمی درمانی بهتر پاسخ میدهند.
در درمان کارسینومهای سلول غیر کوچک در مراحل I و II اولین مرحله جراحی است. فرصتی برای بهبودی طولانی مدت است. در مراحل پیشرفتهتر، شیمیدرمانی و رادیوتراپی بهصورت جداگانه یا ترکیبی، احتمالاً با جراحی تکمیل میشوند. اگر متاستازهای دورتر قبلاً رخ داده باشد، شانس بهبودی به میزان قابل توجهی کاهش مییابد. سپس درمان در درجه اول با هدف پیشگیری یا کند کردن پیشرفت بیماری، تسکین علائم و حفظ کیفیت زندگی است.
عمل جراحی برای درمان سرطان ریه
جراحی معمولاً اولین گزینه برای درمان کارسینوم برونش است، به ویژه در مراحل اولیه I و II. بسته به اندازه و گسترش سلولهای تومور، با این حال، جراحی هنوز میتواند در مراحل بعدی انجام شود. هدف از این عمل برداشتن کامل بافت تومور تا حد امکان است. در طول این روش، پزشک غدد لنفاوی مجاور را نیز برمیدارد تا آنها را در آزمایشگاه بررسی کند. روشهای جراحی مختلفی وجود دارد که به وسعت و اندازه تومور بستگی دارد:
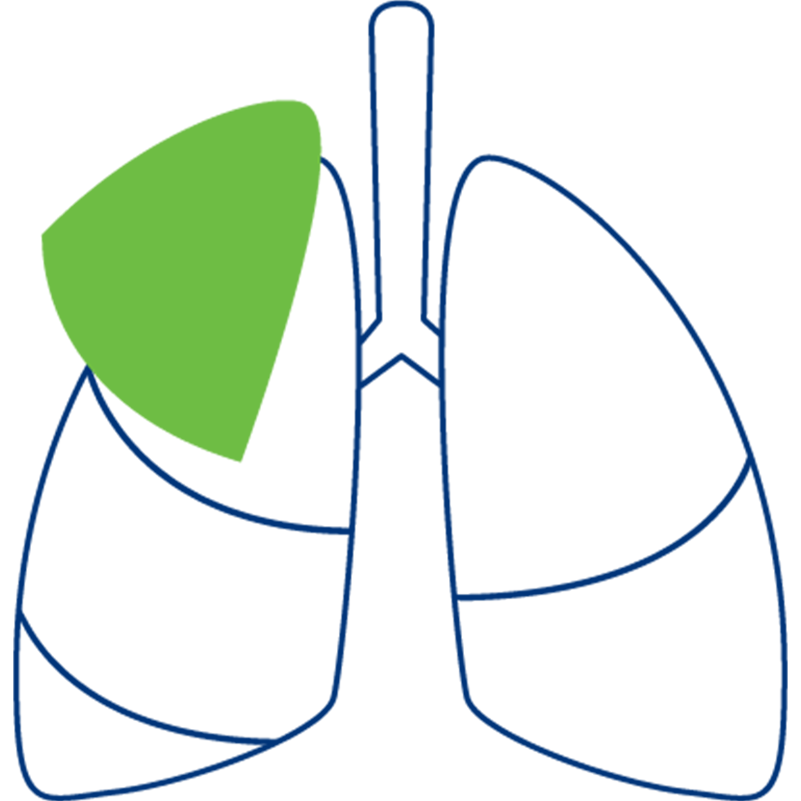
رزکسیون غیر معمول (رزکسیون گوه ای):
برداشتن گوهای شکل بافت ریه آسیب دیده که از ساختار ریه پیروی نمی کند. بافت سالم اطراف حفظ میشود.
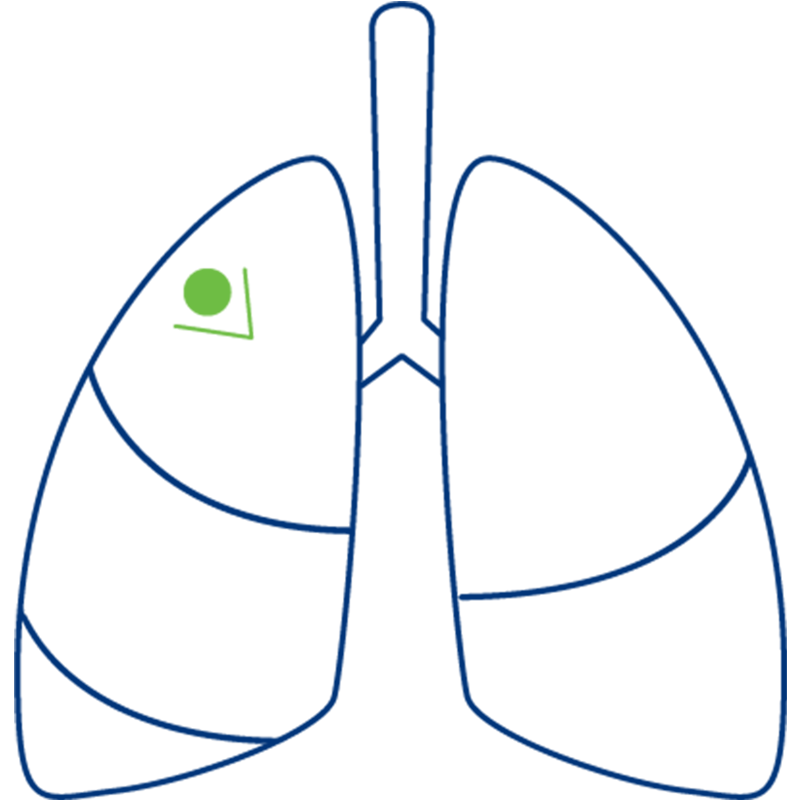
بیلوبکتومی:
لوب ریه مجاور ریه راست علاوه بر آسیب دیده برداشته میشود. اگر رشد تومور فراتر از مرز یک لوب ریه گسترش یابد ضروری است.
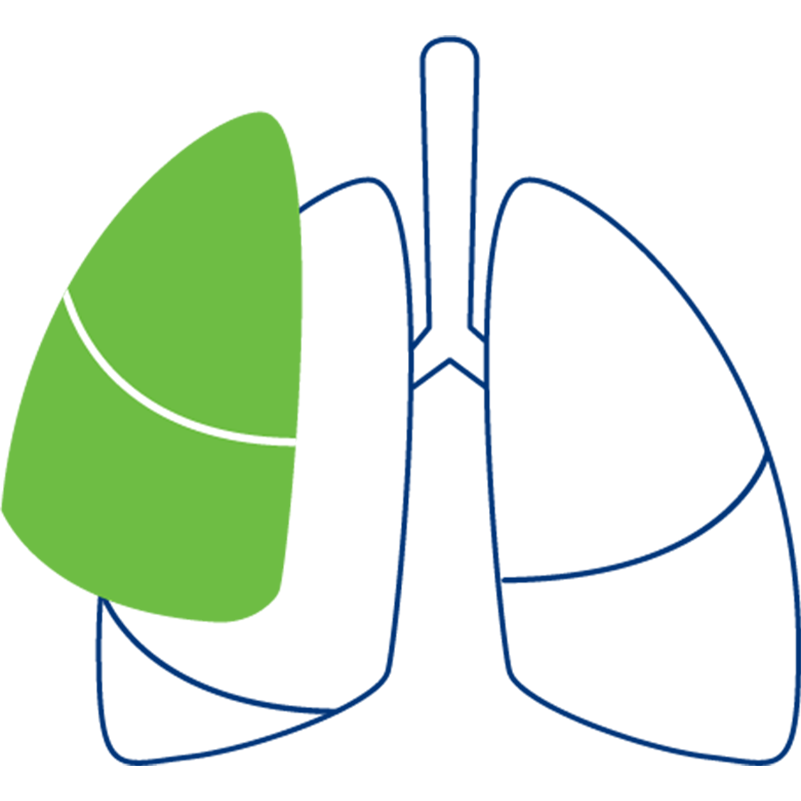
لوبکتومی:
برداشتن کامل یا جزئی یک لوب ریه؛ پیش نیاز این است که تومور به یک لوب ریه محدود شود.
پنومونکتومی:
برداشتن کامل یک ریه به دلیل، برای مثال، تومورهای بزرگ یا کانونهای سرطانی متعدد.
اینکه آیا یک عمل برای درمان مناسب است یا خیر، به بیماریهای احتمالی قبلی یا همزمان بستگی دارد. به عنوان مثال، اگر بیماری قلبی سلامت عمومی را تضعیف کند، ممکن است خطر جراحی بسیار زیاد باشد و پرتودرمانی (استریوتاکتیک) مناسبتر باشد. علاوه بر این، باید اطمینان حاصل شود که قسمت باقیمانده از ریهها میتواند به اندازه کافی تنفس را به عهده بگیرد. در برخی موارد نیز لازم است ابتدا تومور با شیمی درمانی یا رادیوتراپی (درمان نئوادجوانت) کوچک شود و تنها پس از آن با جراحی برداشته شود.
جراحی ریه تحت بیهوشی عمومی و بسته به محل و اندازه تومور، با حداقل تهاجم یا باز انجام میشود. به طور معمول یک روش کم تهاجمی فقط برای تومورهای بسیار کوچک در مراحل اولیه استفاده میشود و باقی موارد نیاز با جراحی باز انجام میشود. پزشک همیشه بافت آسیب دیده را با فاصله ایمنی مشخصی برمی دارد. این بدان معناست که او مقداری بافت سالم اضافی در اطراف تومور میگیرد تا مطمئن شود هیچ سلول توموری باقی نمانده باشد. اگر برخی از سلولهای تومور در ریهها باقی بمانند، ممکن است جراحی بیشتری لازم باشد.
پس از عمل، بافت ریه باقیمانده باید عملکرد کامل تنفسی را بر عهده بگیرد. به همین دلیل، عملکرد بدنی شما در ابتدا پایینتر است و نفس کشیدن عمیق برای شما دشوار خواهد شد. اما با توانبخشی و تمرینات تنفسی هدفمند، میتوانید به طور مؤثری از عملکرد ریه خود حمایت کنید. برای تسکین درد بعد از عمل میتوانید درد درمانی دریافت کنید.
رادیوتراپی یا پرتو درمانی برای درمان برای درمان سرطان ریه
پرتودرمانی که به نام رادیوتراپی نیز شناخته میشود، میتواند به عنوان مکمل یا جایگزین عمل انجام شود. به عنوان یک درمان نئوادجوانت، میتواند تومور را قبل از عمل کوچک کند. اگر عمل جراحی امکانپذیر نباشد، مثلاً به دلیل سایر بیماریها یا محدودیت شدید عملکرد ریه، پزشک میتواند تابش تومور را تجویز کند. ترکیب با شیمی درمانی نیز امکانپذیر است. در تمام استادیومها قابل استفاده است.
اما پرتودرمانی چگونه تاثیر میگذارد؟
سلولهای سرطانی در معرض تشعشعات پرانرژی قرار میگیرند که به DNA سلولهای تومور آسیب میزند و در نتیجه رشد تومور را مهار کرده و سلولها را از بین میبرد. پرتودرمانی یک درمان موضعی است، به این معنی که میتواند تومور یا متاستاز را هدف قرار دهد اما نمیتوان از آسیب دیدن سلولهای سالم بدن نیز توسط پرتوها جلوگیری کرد. با این حال، اینها معمولاً قادر به ترمیم آسیب ناشی از DNA هستند اما سلولهای سرطانی نمیتوانند این کار را انجام دهند، میمیرند و توسط سلولهای ایمنی از بین میروند. به همین دلیل است که پرتودرمانی در چندین جلسه انجام میشود. در این بین سلولهای سالم بدن میتوانند بازسازی شوند.
پرتودرمانی معمولاً میتواند به صورت سرپایی انجام شود. قبل از اولین پرتو، پزشک محل دقیق تومور را در بدن تعیین میکند. با کمک معاینه MRI یا CT، پزشک معالج دقیقاً ناحیه مورد تابش را مشخص میکند و آن را روی پوست فرد مورد نظر برای جلسات بعدی علامتگذاری میکند. خود تشعشع معمولاً فقط چند دقیقه طول میکشد و قابل توجه نیست.
شکل خاصی از پرتو درمانی براکی تراپی است که در آن پرتو از فاصله نزدیک و معمولاً تحت بیهوشی انجام میشود. در مورد سرطان ریه، پزشک به اصطلاح اپلیکاتور حاوی ماده رادیواکتیو را از طریق نای به سمت تومور هل میدهد. به این ترتیب میتوان ناحیه آسیب دیده ریه را مستقیماً درمان کرد. این شکل از پرتودرمانی را میتوان در مراحل پیشرفته به عنوان بخشی از درمان تسکینی در نظر گرفت. در موارد نادرتر، در مراحل اولیه سرطان ریه نیز استفاده میشود، به عنوان مثال زمانی که جراحی امکانپذیر نیست.
آیا پرتودرمانی عوارض جانبی ایجاد میکند؟
این مورد بستگی به پرتوهای مورد استفاده، شدت و ناحیه بدن بستگی دارد. علاوه بر این، واکنش همه افراد به تشعشع یکسان نیست. اکثر عوارض جانبی معمولاً پس از درمان خود به خود برطرف میشوند. با این حال، تغییرات پوست، مانند تغییر رنگ تیره، ممکن است باقی بماند. به عنوان مثال، ممکن است عوارض جانبی زیر را در طول پرتودرمانی تجربه کنید:
- خستگی و فرسودگی مداوم
- تحریک پوست و تغییرات پوستی (مشابه آفتاب سوختگی)، لکههای رنگدانه روی پوست
- ریزش مو در ناحیه تحت تابش
- حالت تهوع و سوء هاضمه
- استرس روانی
- سرفه کردن
- پنومونی ناشی از تشعشع
اگر متوجه هر یک از این عوارض شدید، به تیم پزشکی خود اطلاع دهید. بسیاری از عوارض جانبی درمان را میتوان به خوبی با دارو درمان کرد.
درمان سرطان ریه با شیمی درمانی
شیمی درمانی یکی از شناخته شدهترین روشهای درمانی برای بیماریهای سرطانی است و همچنین نقش مهمی در سرطان ریه دارد. امروزه بسیاری از مواد فعال مختلف وجود دارند که از تقسیم سلولی و در نتیجه رشد تومور جلوگیری میکنند. شیمی درمانی تقریباً برای هر مرحله سرطان ریه، به استثنای مرحله I، گزینهای قابل انجام است. این روش معمولاً همراه با سایر درمانها مانند پرتودرمانی یا جراحی استفاده میشود. همچنین میتوان آن را با اشکال هدفمند درمانی مانند ایمونوتراپی ترکیب کرد که در این صورت پزشکان از ایمونوشیمی درمانی صحبت میکنند.
شیمی درمانی چگونه انجام میشود؟
سیتواستاتیک تجویز شده (مهارکننده سلول) از رشد، تقسیم و تکثیر سلولهای تومور به روشهای مختلف جلوگیری میکند و در نتیجه منجر به مرگ آنها میشود. سلولهایی که به طور خاص به طور مکرر تقسیم میشوند بنابراین به ویژه در معرض شیمی درمانی هستند. علاوه بر سلولهای سرطانی، این شامل سلولهای سالم بدن مانند سلولهای غشای مخاطی، سلولهای ریشه مو یا سلولهای خونساز در مغز استخوان نیز میشود، اینگونه است که عوارض جانبی معمولی رخ میدهد. اما در اینجا نیز سلولهای سالم بدن بر خلاف سلولهای تومور، میتوانند آسیبهای ناشی از سیتواستاتیکها را ترمیم کنند و عوارض جانبی معمولاً دائمی نیستند. شیمی درمانی نیز به صورت چرخهای انجام میشود تا زمان بهبودی کافی برای سلولهای سالم فراهم شود.
میتوانید سیتواستاتیک را به تنهایی (تک درمانی) یا در ترکیب با سایر سیتواستاتیکها یا اشکال درمانی (درمان ترکیبی) دریافت کنید. شیمی درمانی را به صورت تزریق از طریق ورید دریافت خواهید کرد. در نتیجه، سیتواستاتیک در سراسر بدن توزیع میشود و اثر سیستمیک (روی کل بدن) دارد. بنابراین در برابر متاستازهای بسیار کوچک سلولهای تومور و زخمهای ثانویه (متاستاز) نیز هدایت میشود.
شیمی درمانی در چرخههای درمانی انجام میشود:
یک چرخه شامل روز انفوزیون (روز اول سیکل) و استراحت بعدی است که معمولاً چندین روز طول میکشد. بسته به طرح درمانی، یک چرخه میتواند شامل چندین انفوزیون در روزهای مشخص نیز باشد. طول هر سیکل از جمله به داروی مورد استفاده و وضعیت سلامتی بیمار بستگی دارد. بنابراین، خرمای دم کرده معمولاً طی چند هفته یا چند ماه پخش میشود. ممکن است قبل از شیمی درمانی به شما داروی اضافی داده شود تا به شما در تحمل بهتر شیمی درمانی کمک کند. در اکثر مواقع، درمان میتواند به صورت سرپایی انجام شود، یعنی میتوانید پس از تزریق به خانه بروید و پس از درمان بهبود پیدا کنید.
جهت درمان سرطان ریه، شیمی درمانی بسته به مرحله میتواند اهداف متفاوتی داشته باشد. در مراحل اولیه، هدف درمان سرطان است. متخصصان به این روش درمانی درمانی میگویند. قبل از عمل، شیمی درمانی میتواند اطمینان حاصل کند که تومور کوچک شده و میتواند راحتتر برداشته شود. پس از عمل، در نظر گرفته شده است که سلولهای سرطانی باقیمانده را از بین ببرد تا از رشد مجدد تومور جلوگیری شود. در مراحل پیشرفته، تمرکز بر حفظ وضعیت فعلی سلامت و بهبود کیفیت زندگی است. هدف شیمی درمانی کاهش سرعت پیشرفت بیماری است. این یک درمان تسکینی است.
نمی توان پیشبینی کرد که کدام عوارض جانبی رخ میدهد و چقدر شدید هستند. آنها به دارو بستگی دارند و همچنین از فردی به فرد دیگر متفاوت هستند. عوارض جانبی در هر فردی که داروی خاصی را دریافت میکند، رخ نمیدهد. امروزه معمولاً میتوان عوارض جانبی شیمی درمانی را به خوبی درمان کرد یا از آن پیشگیری کرد.
عوارض جانبی شیمی درمانی ممکن است شامل موارد زیر باشد:
کسالت عمومی
اسهال، حالت تهوع و استفراغ
افزایش خطر ابتلا به عفونت به دلیل ضعف سیستم ایمنی
مشکلات تمرکز و خستگی (خستگی) و همچنین ضعف
کمبود سلولهای خونی
التهاب مخاط دهان
اختلالات لخته شدن خون
ریزش موی موقت
اگر یک یا چند مورد از این عوارض جانبی را تجربه کردید، به تیم پزشکی خود اطلاع دهید. میتواند به شما در مقابله با عوارض جانبی کمک کند و داروهای مناسب را به شما بدهد.
درمانهای هدفمند
درمانهای هدفمند به ویژه در مراحل پیشرفته و متاستاتیک اهمیت دارند. این داروها برای تعامل با مولکولهای بسیار خاص، مانند ویژگیهای سطحی سلولهای سرطانی طراحی شدهاند. چندین ویژگی شناخته شده سرطان ریه وجود دارد که میتواند با درمان هدفمند مورد هدف قرار گیرد. بنابراین هنگام تشخیص، بررسی دقیق نوع سرطان ریه و وجود برخی نشانگرهای زیستی یا تغییرات ژنتیکی بسیار مهم است. اگر چنین است، داروهای هدفمند میتوانند دقیقاً با ویژگیهای سلولهای سرطانی تنظیم شوند.با این حال، هر بیمار برای این نوع درمان مناسب نیست.
درمانهای هدفمند عبارتند از:
- ایمونوتراپی
- مهارکنندههای تیروزین کیناز
- مهارکنندههای رگزایی
ایمونوتراپی
ایمونوتراپی یک روش درمانی مدرن و هدفمند است که از سیستم ایمنی بدن در مبارزه با سرطان حمایت میکند. سیستم ایمنی انسان نیروی پلیس بدن است و وظیفه دفاع در برابر عوامل بیماریزا مانند ویروسها و باکتریها را بر عهده دارد. همچنین سلولهای درونزا قدیمی یا بیمار مانند سلولهای سرطانی را شناسایی و از بین میبرد. با این حال، برخی از سلولهای سرطانی میتوانند سیستم ایمنی را با خاموش کردن سلولهای دفاعی فریب دهند و در نتیجه از سیستم ایمنی پنهان شوند. آنها از ویژگیهای خاصی بر روی سطح خود استفاده میکنند که به آنایست بازرسی میگویند و به عنوان پوششی از نامرئی بودن استفاده میکنند. به عنوان مثال یکی از این پستهای بازرسی PD-۱/PD-L۱ است.
آنها از طریق این نقاط بازرسی با سلولهای ایمنی ارتباط برقرار میکنند و به سیستم ایمنی سیگنال میدهند که آنها هیچ خطری ندارند و واکنش دفاعی لازم نیست. در نتیجه سلولهای ایمنی به نوعی حالت خفته میروند و دیگر سلولهای سرطانی را به عنوان یک تهدید نمیشناسند. سلولهای تومور مورد حمله قرار نمیگیرند و میتوانند بدون مزاحمت تقسیم شوند و تومور میتواند رشد کند.
اما چگونه ایمونوتراپی این مکانیسم استتار را دور میزند؟
ایمونوتراپی تضمین میکند که سلولهای ایمنی دوباره فعال میشوند تا بتوانند عملکرد طبیعی خود را از سر بگیرند و به تومور حمله کنند. آنتیبادیهای درمانی، در این مورد به اصطلاح بازدارنده هایایست بازرسی، استفاده میشود. اینها برای ویژگیهای سطحی مختلف روی سلولهای سرطانی یا سلولهای ایمنی (سلولهای T) سفارشی ساخته شدهاند. آنتیبادیها دقیقاً به نقاط بازرسی مناسب روی سطوح سلولی متصل میشوند و آنها را مسدود میکنند. سلولهای ایمنی دوباره «روشن» میشوند، سلولهای سرطانی را بدخیم میشناسند و به آنها حمله میکنند. برای مثال، برخلاف شیمیدرمانی، داروهای مورد استفاده در ایمونوتراپی مستقیماً به سلولهای سرطانی حمله نمیکنند، بلکه سلولهای سرطانی خود بدن را فعال میکنند. سلولهای ایمنی برای مبارزه با تومور.
درمان سرطان ریه با ایمونوتراپی چگونه انجام میشود؟
شما ایمونوتراپی را به صورت تزریق در ورید بازو یا از طریق یک پورت دریافت خواهید کرد. بسته به نوع آمادهسازی، حدود دو یا سه هفته بین تاریخ انفوزیون فاصله وجود دارد. زمان تزریق ایمونوتراپی معمولاً بسیار کوتاه است، حدود نیم ساعت تا یک ساعت. با این حال، آنها همچنین میتوانند همراه با شیمی درمانی (ایمونوشیمی درمانی) تجویز شوند. در این مورد، زمان تزریق شیمی درمانی اضافه میشود، زیرا بیماران آمادهسازیهای مختلف را یکی پس از دیگری دریافت میکنند. تزریق معمولاً به صورت سرپایی امکانپذیر است و پس از آن میتوانید دوباره به خانه بروید.
ایمونوتراپی برای چه کسانی مناسب است؟
ایمونوتراپی به مکانیسمهای بسیار خاصی حمله میکند. بنابراین، برای همه به یک اندازه مناسب نیست. بنابراین، پزشک برای هر بیمار به طور جداگانه بررسی میکند که آیا و اگر چنین است، کدام ایمونوتراپی مناسب است یا خیر. عوارض جانبی ایمونوتراپی زمانی رخ میدهد که سیستم ایمنی بدن در اثر درمان بیش از حد برانگیخته شود. عوارض جانبی احتمالی ایمونوتراپی میتواند شامل موارد زیر باشد:
- خستگی مداوم (خستگی)
- کاهش وزن
- تشنگی یا اشتهای زیاد، تکرر ادرار
- حالت تهوع یا استفراغ
- اسهال یا درد شکم
- سرفه کردن
- تنگی نفس
- تب
- بثورات، خارش
- سردرد، گیجی
- ضعف یا درد عضلانی
به خصوص مهم است که تیم پزشکی که از شما مراقبت میکند را به سرعت از علائم یا عوارض جانبی جدید یا در حال تغییر مطلع کنید. زیرا این خطر وجود دارد که سیستم ایمنی بیش از حد فعال شده، علیه اندامهای خود بچرخد و باعث التهاب شدید شود. این عوارض جانبی ناشی از سیستم ایمنی به راحتی قابل درمان یا پیشگیری هستند.
مهارکنندههای تیروزین کیناز
یکی از راههایی که سلولهای تومور با سلولهای سالم بدن تفاوت دارند این است که بدون کنترل تقسیم میشوند. آنها دیگر به سیگنالهای توقف طبیعی بدن پاسخ نمیدهند. مسیرهای سیگنالی که به طور معمول زمان و تعداد دفعات تقسیم یک سلول را تنظیم میکنند، اغلب در سلولهای سرطانی بیش فعال هستند. بنابراین، سلول سرطانی به طور مداوم سیگنال تقسیم را دریافت میکند.
این میتواند به دلیل برخی تغییرات ژنتیکی در سلولهای سرطانی باشد. با شناسایی مکانیسمهای دقیق، دانشمندان توانستند دقیقاً مهارکنندههای تیروزین کیناز را ایجاد کنند که این مسیرهای سیگنالینگ را مسدود میکند و در نتیجه رشد تومور را کند میکند. اینکه کدام مکانیسمها در سلولهای سرطانی فعال هستند، میتواند از توموری به تومور دیگر بسیار متفاوت باشد. برای تعیین این موضوع، یک آزمایش ژنتیکی مولکولی قبلی ضروری است.
فقط در این صورت پزشک میتواند تعیین کند که آیا و اگر چنین است، کدام مهارکنندههای تیروزین کیناز مناسب هستند یا خیر. سپس شما مهارکننده تیروزین کیناز مناسب برای جهش خود را دریافت خواهید کرد، مانند یک مهارکننده برای EGFR، ALK یا تیروزین کیناز ROS۱.
مهارکنندههای تیروزین کیناز دقیقاً چگونه کار میکنند؟
سلولها برای تقسیم به سیگنال نیاز دارند. آنها معمولاً این سیگنال رشد را از بیرون از طریق نقاط اتصال (گیرنده) دریافت میکنند. گیرندهها سیگنال را به داخل سلولها ارسال میکنند، جایی که باعث تقسیم سلولی میشوند.
مولکولهای خاصی، به اصطلاح تیروزین کیناز، مسئول انتقال سیگنال در داخل سلول هستند. میتوانید آن را مانند یک تماس تلفنی در نظر بگیرید: هر بار که تماسی از بیرون با سیگنال تقسیم سلولی میآید، گیرنده تماس(تیروزین کیناز ) پیام را منتقل میکند و سلول تقسیم میشود. اگر تیروزین کینازها به طور دائمی فعال شوند، سلولها به طور مداوم سیگنال تقسیم را دریافت میکنند که سلولهای سرطانی بیشتر و بیشتر تشکیل میشوند و تومور رشد میکند.
مهارکنندههای تیروزین کیناز داروهایی هستند که به اندازه کافی کوچک هستند تا به داخل سلولها نفوذ کنند. در آنجا آنها به طور خاص تیروزین کینازها را هدف قرار داده و آنها را مسدود میکنند. بنابراین از ارسال پیام توسط گیرنده جلوگیری میکنید. تیروزین کینازها دیگر نمیتوانند سیگنالهای رشد را منتقل کنند و سلولهای سرطانی دیگر تقسیم نمیشوند و میمیرند.
مهارکنندههای تیروزین کیناز سیگنالهای رشد را مسدود میکنند و در نتیجه رشد تومور را کند میکنند.
مهارکنندههای تیروزین کیناز به شکل قرص هستند که میتوانید در خانه مصرف کنید. برای مثال در سرطان ریه، جهشهای EGFR، ALK و ROS۱ را میتوان با مهارکنندههای تیروزین کیناز درمان کرد.
این گزینه درمانی را میتوان با سایر درمانهای سرطان، مانند مهارکننده رگ زایی، ترکیب کرد. اینکه آیا و کدام عوارض جانبی رخ میدهد بستگی به آمادهسازی دارد و برای هر فرد متفاوت است.
ممکن است عوارض جانبی زیر را با مهارکنندههای تیروزین کیناز مشاهده کنید:
- بثورات آکنه مانند (بثورات پوستی)
- کاهش اشتها، کاهش وزن
- خونریزی در دستگاه گوارش یا خونریزی بینی
- بیماری اعصاب بازوها و پاها
- سرگیجه
- اختلالات بینایی
- تغییرات در شمارش خون
- مشکلات گوارشی مانند تهوع، اسهال یا یبوست
اگر یک یا چند مورد از این عوارض جانبی را تجربه کردید، به تیم مراقبتهای بهداشتی خود اطلاع دهید. بسیاری از عوارض جانبی درمان را میتوان به خوبی با دارو درمان کرد.
مهارکننده رگ زایی
سلولهای سرطانی به طور مکرر تقسیم میشوند و بنابراین به انرژی زیادی نیاز دارند. هنگامی که تومور به اندازه معینی رسید، به خون خود نیاز دارد تا بتواند اکسیژن و مواد مغذی کافی را دریافت کند. به منظور پوشش انرژی مورد نیاز بالای تومور، رگهای خونی جدید برای تأمین سلولهای سرطانی تشکیل میشوند. رشد رگهای خونی در اصطلاح فنی «رگزایی» نامیده میشود. مهارکنندههای رگ زایی از تشکیل رگهای خونی جدید جلوگیری میکنند.
اما مهارکنندههای رگ زایی دقیقاً چگونه کار میکنند؟
یک تومور میتواند سیگنالهای خاصی را برای تحریک رشد رگهای خونی ارسال کند. این سیگنالها به اصطلاح فاکتورهای رشد هستند، به طور دقیقتر فاکتورهای رشد عروقی (VEGFR = فاکتور رشد اندوتلیال عروقی). به بدن میگوید چه نیازی دارد و بدن با تشکیل رگهای خونی جدید و در نتیجه تأمین مواد مغذی و اکسیژن تومور واکنش نشان میدهد. برای جلوگیری از رشد رگهای خونی، مهارکنندههای رگزایی به این فاکتور رشد متصل میشوند و آن را مسدود میکنند یا به عبارتی سیگنالها را قطع میکنند .
در نتیجه، نمیتواند سیگنال را برای ادامه رشد و تأمین تومور به رگهای خونی در مجاورت تومور منتقل کند. علاوه بر این، عروق خونی تأمینکننده تومور موجود پسرفت میکنند. سلولهای سرطانی دیگر اکسیژن و مواد مغذی کافی دریافت نمیکنند و میمیرند. در نتیجه، مهارکنندههای رگزایی نیز میتوانند با تشکیل (بیشتر) متاستازها مقابله کنند.
یک مهارکننده رگ زایی معمولاً همراه با شیمی درمانی تجویز میشود. همچنین میتوان یک مهارکننده رگ زایی همراه با یک مهارکننده تیروزین کیناز یا ایمونوتراپی تجویز کرد. اثرات آمادهسازیهای مختلف مکمل یکدیگر هستند. به عنوان یک قاعده، تا زمانی که سرطان پیشرفت نکند یا بیمار یا پزشک معالج به دلیل عوارض جانبی نخواهند درمان را ادامه دهند، درمان با مهارکنندههای رگزایی انجام میشود.
مهارکنندههای رگ زایی همچنین میتوانند تشکیل رگهای خونی در خارج از محیط تومور را مختل کنند. این میتواند منجر به خونریزی یا اختلالات بهبود زخم شود. با این حال، همه این عوارض جانبی را تجربه نمیکنند.
عوارض جانبی احتمالی مهارکنندههای رگزایی میتواند شامل موارد زیر باشد:
- خستگی مداوم (خستگی)
- از دست دادن اشتها و سوء هاضمه
- تشکیل لخته خون (ترومبوز)
- فشار خون بالا
- خونریزی، به عنوان مثال در دستگاه گوارش
- بیماریهای اعصاب در بازوها و پاها
- سردرد
- تغییرات در شمارش خون
اگر متوجه یک یا چند مورد از این عوارض شدید، به تیم پزشکی خود اطلاع دهید. اکثر عوارض جانبی را میتوان به خوبی با دارو درمان کرد.
درمان متاستاز در سرطان ریه
در سرطان پیشرفته ریه، متاستاز میتواند در بسیاری از قسمتهای مختلف بدن رخ دهد. گزینههای درمانی زیر برای درمان امکانپذیر است:
متاستازهای مغزی: رادیوتراپی استریوتاکتیک یا جراحی با پرتوهای کمکی
متاستازهای آدرنال: پرتودرمانی یا جراحی
متاستازهای استخوانی: پرتودرمانی یا جراحی
مراقبت تسکینی
مراقبت تسکینی برای درمان سرطان ریه در نظر گرفته نشده است. این دارو علیه درد و سایر عوارض جانبی با هدف بهبود کیفیت زندگی در سرطان پیشرفته ریه تجویز میشود. علیرغم این بیماری، آنها باید بتوانند تا حد امکان به زندگی مستقل خود ادامه دهند. چون علیرغم همه چیز گزینههای درمانی سرطان ریه در مراحل پیشرفته قابل درمان نیست، برای مثال اگر تومور را دیگر نتوان به طور کامل با جراحی خارج کرد یا متاستاز ایجاد شده باشد. در این موارد مراقبت تسکینی در اولویت است. برای مثال، در اینجا، مهارکنندههای تیروزین کیناز یا شیمی درمانی امکانپذیر است.
اگر بیماران دیگر به این گزینههای درمانی پاسخ ندهند و در وضعیت عمومی بسیار بدی باشند، بهترین مراقبتهای حمایتی ممکن را دریافت میکنند. در اینجا نیز هدف تسکین درد و تضمین بهترین کیفیت زندگی ممکن است.
مراقبت تسکینی شامل انواع روشهای درمانی است. اینها شامل هر دو رویکرد مبتنی بر دارو، مانند مسکنهای درد، و گزینههای غیردارویی، مانند درمان تنفسی و فیزیوتراپی برای تسکین تنفس است.
همچنین میتوانید از پیشنهادات خدمات پرستاری در منزل استفاده کنید و برای مثال در مورد بهداشت شخصی یا کارهای خانه کمک بگیرید. گزینه دیگر حمایت روانی انکولوژیک یا خدمات مشاوره روانی اجتماعی است.
درمان سرطان عودکننده ریه
عود کارسینوم برونش را عود میگویند. به خصوص تومورهایی که دیر کشف میشوند میتوانند عود کنند. خطر عود در دو سال اول بیشتر است. خطر عود هر چه از بیماری اولیه دورتر شود، کاهش مییابد، اما خطر تومورهایی که میتوانند در نقطهای دیرتر از زمان و یا در قسمتی از بدن متفاوت از سرطان واقعی ریه (کارسینوم ثانویه) رخ دهند، افزایش مییابد.
درمان به وضعیت عمومی، تغییرات ژنتیکی احتمالی در سلولهای سرطانی و درمانهای قبلی بستگی دارد. به عنوان مثال، اگر قبلاً ایمونوتراپی دریافت نکردهاید، این نوع درمان میتواند گزینهای برای شما باشد. گزینههای دیگر عبارتند از: مهارکنندههای رگزایی، مهارکنندههای تیروزین کیناز، ترکیبی از درمان هدفمند با شیمیدرمانی، یا شیمیدرمانی به تنهایی.
مراقبتهای بعدی برای سرطان ریه
پس از درمان سرطان، باید به طور منظم ویزیتهای پیگیری داشته باشید. این بررسیها به شناسایی عود یا پیشرفت احتمالی بیماری در مراحل اولیه و شروع درمان مناسب کمک میکند. علاوه بر تاریخچه و معاینه فیزیکی، معاینات شامل سی تی اسکن قفسه سینه و تست عملکرد ریه نیز میشود.
مجوز مراقبتهای بعدی میتواند به شما کمک کند تا قرار ملاقاتهای مراقبتهای بعدی و غیره را از دست ندهید. گزینه توانبخشی یا به اختصار توانبخشی نیز وجود دارد. این میتواند به صورت سرپایی یا بستری انجام شود و برای مثال میتواند پزشکی یا حرفهای باشد. به عنوان مثال، توانبخشی پزشکی به شما تمرینات تنفسی و فیزیوتراپی را برای تقویت ریهها و قفسه سینه میآموزد. همچنین میتوانید از حمایت روانی بهرهمند شوید. توانبخشی حرفهای میتواند به شما کمک کند اگر دیگر نمیتوانید کار قبلی خود را انجام دهید، به سر کار خود بازگردید یا شغل جدیدی پیدا کنید.
- آموزش و پژوهش 3
- اخبار و تفاهم نامه ها 15
- خدمات 15
- مصاحبه با پیشکسوتان 14
- مقالات 165
- ویدئو 48
- ویدئوهای آموزشی 31
- ویدئوهای جراحی 29
-

آموزش ورزش های بازتوانی ریه توسط دکتر اردا کیانی
21 فروردین 1402 -

خلط گلو نشانه چیست + درمان خلط گلو!
27 تیر 1403 -

ویدئو: گفتگو دکتر اردا کیانی با دکتر علی اصغر هنرمند
18 تیر 1403 -

هزینه برونکوسکوپی چقدر است؟
12 تیر 1403 -
عوارض برونکوسکوپی: مهمترین نکات که باید بدانید!
19 تیر 1403 -

عوارض برونکوسکوپی در کودکان!
7 خرداد 1403 -

انواع تنگی نفس و تفاوت تنگی نفس قلبی و ریوی!
31 اردیبهشت 1403 -

انواع سرفههای خطرناک: علائم، علل و زمان درمان
24 اردیبهشت 1403 -

قلیان اکسیژن چیست و چه مضراتی دارد؟
17 اردیبهشت 1403 -

شربت سرفه کودکان: نحوه مصرف و کاربرد آن!
10 اردیبهشت 1403 -
برای عفونت ریه چه چیزی بخوریم؟ ویتامین، مواد غذایی و داروها!
4 اردیبهشت 1403




